Głównymi organellami odpowiedzialnymi za prawidłowe funkcjonowanie komórki są mitochondria. Jest tak nie tylko dlatego, że zawierają one białka łańcucha oddechowego zaangażowane w procesy produkcji energii, ale także ponieważ odpowiadają za równowagę redoks oraz regulację śmierci komórkowej. Dysfunkcja tych organelli jest więc dla komórki szczególnie niebezpieczna, a nagromadzenie uszkodzonych mitochondriów może prowadzić do upośledzonego funkcjonowania, a nawet śmierci komórki. By się przed tym uchronić, komórki przeprowadzają swoistą „kontrolę jakości” mitochondriów, usuwając te uszkodzone za pośrednictwem procesu mitofagii. Zarówno dysfunkcyjne działanie mitochondriów, jak i zmiany w procesie mitofagii są coraz częściej przywoływane jako jeden z mechanizmów rozwoju wielu chorób, w tym chorób zwłóknieniowych płuc czy wątroby. Niezmiennie od lat choroby zwłóknieniowe stanowią poważne wyzwanie kliniczne. Zwłóknienie, czyli nadmierne odkładanie włókien kolagenowych w obrębie tkanki, często prowadzi do nieodwracalnych zmian i upośledza prawidłowe działanie narządu, w którym występuje. Choroby trzustki są szczególnie aktualnym przykładem zwłóknienia. W 2016 roku ponad 5 milionów osób na całym świecie usłyszało diagnozę związaną ze zwłóknieniem tego narządu, a liczba ta notuje rokrocznie kilkudziesięcioprocentowy wzrost. Pomimo tego, współczesna medycyna wciąż nie dysponuje skutecznymi strategiami terapeutycznymi dla osób dotkniętych tymi schorzeniami. Za zwłóknienie w trzustce odpowiedzialne są komórki stelarne, które stanowią zaledwie 4-7% masy narządu. Choć fizjologicznie występują w stanie wyciszonym, to mogą ulegać aktywacji pod wpływem uszkodzeń mechanicznych organu lub toczącego się stanu zapalnego. W tym stanie produkują one łącznotkankową macierz bogatą we włókna kolagenowe, która odkłada się w obrębie narządu i prowadzi do jego zwłóknienia. W związku z tym, że zaktywowane komórki stelarne bardzo różnią się od komórek wyciszonych, celem projektu jest zbadanie i porównanie funkcjonowania mitochondriów pomiędzy tymi dwoma fenotypami. Porównana zostanie także rola i efektywność mitofagii w tych komórkach. Aby tego dokonać, kształt i organizacja mitochondriów zostaną zobrazowane z wykorzystaniem mikroskopii elektronowej, umożliwiającej pomiary z dużą rozdzielczością. Porównana zostanie także ilość i struktura białek łańcucha oddechowego w tych komórkach. Wiedząc, że prawidłowe działanie mitochondriów opiera się na sygnałach wapniowych oraz równowadze reaktywnych form tlenu i protonów, w mitochondriach komórek zostaną dokonane pomiary sygnałów wapniowych, a także zmiany redoks i pH. Kondycja mitochondriów i metabolizm mitochondrialny zostaną ocenione z wykorzystaniem testu stresu mitochondrialnego. Aby zbadać rolę mitofagii w komórkach stelarnych, zastosowana zostanie specyficzna sonda fluorescencyjna umożliwiająca obrazowanie procesu z wykorzystaniem mikroskopii fluorescencyjnej i jej ilościową analizę przy pomocy cytometrii przepływowej. Dodatkowo, szczegółowo scharakteryzowana zostanie rola związków modulujących proces mitofagii i ich wpływ na fizjologię, metabolizm i śmierć komórkową. Ten projekt opiera się na badaniach podstawowych, mających na celu uzupełnienie wiedzy dotyczącej roli zmian na poziomie mitochondrialnym w aktywacji komórek stelarnych trzustki. Niemniej jednak uzyskane wyniki mogą przyczynić się do głębszego zrozumienia patofizjologii procesów zwłóknieniowych, a w konsekwencji pomóc w opracowaniu nowych strategii terapeutycznych różnych schorzeń związanych z patofizjologicznym zwłóknieniem.
Skuteczne leczenie guzów nowotworowych zlokalizowanych w obrębie ośrodkowego układu nerwowego (OUN) stanowi dramatyczne wyzwanie dla współczesnej neuroonkologii. Klasyfikacja WHO wyróżnia ich cztery podtypy: m.in gwiaździak pilocytarny i rozlany I/II stopnia; oraz guzy III/IV stopnia, tj. gwiaździak anaplastyczny i glejak wielopostaciowy (glioblastoma multiforme; GBM), czyli nowotwory OUN „o wysokim stopniu złośliwości”. W szczególności, współcześnie stosowane strategie terapii guzów III i IV stopnia (zwłaszcza GBM) wciąż cechuje stosunkowo niewielka skuteczność. Efektem tego stanu rzeczy jest często następująca w trakcie lub po klasycznym leczeniu GBM (w tym po zastosowaniu temozolomidu, radioterapii i/lub resekcji chirurgicznej) mikroewolucja lekoopornych i inwazyjnych szczepów komórek nowotworowych. Lekooporność komórek GBM może wynikać ze (i) wzmożonej aktywności transporterów ABC (białka posiadające kasetę wiążącą ATP); (ii) indukcji autofagii prowadzącej do usuwania dysfunkcyjnych (uszkodzonych) organelli, (iii) enzymatycznej naprawy uszkodzeń DNA wywołanych przez leki, oraz (iv) indukcji (pseudo)senescencji (stanu uśpienia komórek). Wszystkie te procesy wymagają znacznych nakładów energetycznych, których źródłem jest metabolizm komórek GBM. Prowadzą one do nawrotów choroby i wysokiej śmiertelności pacjentów z GBM. Ostatnie doniesienia naukowe sugerują, że alternatywą i uzupełnieniem standardowych strategii leczenia GBM może być zastosowanie doksorubicyny; i to zarówno w „monoterapii”, jak i jako leku wspomagającego. Z drugiej strony, wciąż niewiele wiadomo na temat zdolności doksorubicyny do indukcji lekooporności w populacjach komórek GBM, a tym bardziej na temat mechanizmów potencjalnie odpowiedzialnych za ten proces. Wyniki naszych wstępnych analiz wykazały indukcję lekooporności komórek GBM eksponowanych na działanie doksorubicyny oraz następującą po tym mikroewolucję inwazyjnych szczepów tych komórek. Procesy te skorelowaliśmy z wcześniej obserwowaną reorganizacją (fuzją) mitochondriów, hipertrofią komórek i wzrostem intensywności ich oddychania tlenowego. Dane te skłoniły nas do postawienia hipotezy zakładającej, że adaptacja komórek GBM i ich oporność na stres wywołany przez doksorubicynę determinowana jest przez ich "elastyczność metaboliczną", czyli zdolność do przełączania między różnymi „trybami metabolicznymi”. Ta z kolei zależy od dynamiki mitochondriów regulowanej aktywnością mitofuzyn, które są modulatorami architektury mitochondriów w warunkach stresu komórkowego. W szczególności fuzja mitochondriów, wraz z postępującą hipertrofią komórek i wzmożoną produkcją nośników energii (ATP; NAD(P)H) ułatwia selektywną ekspansję odpornych na doksorubicynę i inwazyjnych subpopulacji komórek GBM w warunkach stresu indukowanego lekiem. Celem weryfikacji tej hipotezy, w pierwszej kolejności prześledzimy przebieg przeprogramowania metabolicznego komórek GBM pod wpływem ekspozycji na doksorubicynę, w powiązaniu z analizami architektury mitochondriów. Wykorzystując chemiczne inhibitory, wektory plazmidowe i esiRNA ocenimy rolę mitofuzyn w rearanżacjach mitochondriów i w regulacji współzależności między adaptacją metaboliczną i lekoopornością komórek GBM. Wreszcie, długotrwała ekspozycja komórek GBM na doksorubicynę umożliwi nam określenie mechanizmów i konsekwencji powiązań pomiędzy funkcją mitofuzyn, a mikroewolucja lekooporności komórek GBM. Do tych celów wykorzystamy szereg metod: w tym analizy biochemiczne (tj. profilowanie metaboliczne komórek z wyk. układu Seahorse XFp i testy enzymatyczne), mikroskopowe (przyżyciowa mikroskopia fluorescencyjna, mikroskopia TIRF i TEM) oraz cytometryczne (ImageStreamX). Badania te nie tylko pozwolą opisać możliwe krótko- i długotrwałe konsekwencje ekspozycji komórek GBM na doksorubicynę, ale także umożliwią weryfikację tezy o zaangażowaniu mitofuzyn w indukcji i mikroewolucji „elastyczności metabolicznej” i lekooporności komórek GBM. Wierzymy, że uzyskane wyniki przyczynią się do poznania konsekwencji stosowania doksorubicyny dla progresji GBM oraz pozwolą na optymalizację strategii leczenia GBM w oparciu o ten lek.
Celem Projektu jest realizacja działania naukowego, polegającego na odbyciu przez Kierownika Projektu 3-miesięcznego stażu naukowego w ośrodku zagranicznym, jakim będzie Leibniz Research Laboratories for Biotechnology and Artificial Organs (LEBAO), Hannover Medical School w Niemczech.
Dr Elżbieta Karnas od lat zaangażowana jest w badania nad innowacyjnym wykorzystaniem komórek macierzystych (KM) i ich pochodnych w regeneracji tkanek. W szczególności, zajmuje się badaniem potencjału parakrynnego pęcherzyków zewnątrzkomórkowych (ang. extracellular vesicles; EVs) wydzielanych przez ludzkie indukowane pluripotencjalne KM (ang. human induced pluripotent stem cells; hiPSCs), w kontekście wzmacniania przez nie potencjału biologicznego komórek docelowych, w tym krwiotwórczych komórek macierzystych i progenitorowych z krwi pępowinowej (ang. cord blood-derived hematopoietic stem and progenitor cells; CB-HSPCs). Rezultatem jej badań jest praca wskazująca, że hiPSC-EVs mogą wzmacniać właściwości funkcjonalne CB-HSPCs, kluczowe dla ich potencjału krwiotwórczego in vitro oraz in vivo, co ma istotne znaczenie dla poprawy efektywności wykorzystania krwi pępowinowej jako materiału przeszczepowego w hematologii. Jednakże, dokładne aspekty molekularne aktywności hiPSC-EVs wobec tych komórek pozostają nieznane.
Stąd też, aby w pełni zrozumieć molekularne mechanizmy wpływu funkcjonalnego hiPSC-EVs na CB-HSPCs, planowana jest kontynuacja badań w tym obszarze poprzez zbadanie roli miRNA w tych procesach, które może być przenoszone przez hiPSC-EVs do komórek, wywołując w nich efekt funkcjonalny. Zatem, badania te wymagać będą znajomości technik genetycznej modyfikacji komórek hiPSCs, prowadzącej do wywołania nadekspresji lub wyciszenia wybranych miRNA.
Stąd też, celem stażu dr Karnas będzie zdobycie praktycznego doświadczenia laboratoryjnego w obszarze technik inżynierii genetycznej i modyfikacji komórek (ze szczególnym uwzględnieniem hiPSCs), pod kątem otrzymania w nich nadekspresji lub zahamowania genów kodujących wybrane miRNA. Umiejętności te będą niezbędne w przyszłym planowanym projekcie, związanym z modyfikacją komórek hiPSCs w celu oceny mechanizmu aktywności biologicznej wydzielanych przez te komórki EVs, co może przyczynić się do opracowania nowych strategii poprawy możliwości zastosowania KP w praktyce klinicznej.
Cells participating in such processes as embryogenesis, wound healing and tissue regeneration have to be guided specifically to the site of action in order to perform their functions. For example, cell migration through an increasing gradient of soluble chemoattractant created in the healing tissue is a common way of cell recruitment to the wound site. However, cells may also respond to other factors such as adhesion site gradient, matrix topography or matrix stiffness by directed migration. Moreover, one of the first directional cues that appear in the skin immediately after wounding is a direct current electric field. The presence of endogenous electric fields (EFs) within extracellular spaces has been known for more than 150 years; however the significance of the EFs for numerous physiological processes has only recently been confirmed by several modern techniques. It was documented in a number of reports that the EFs are present in all developing and regenerating animal tissues and play a key role in major biological processes such as embryogenesis, wound healing and tissue regeneration. Most organs and embryos surrounded by a layer of epithelial cells produce potential difference or transepithelial potentials of few millivolts to tens of millivolts. A major cellular effect of the EF is electrotaxis, that is a directional movement towards the cathode or anode. It should be noted that the active migratory response is completely different from the movement of a non-live charged particle due to a pure physical force, because cells respond to the EF by active directional migration!
In vitro application of the EF of strengths comparable with those detected in vivo produces electrotaxis in a variety of cultured cells. Although several mechanisms and signalling pathways were suggested to be involved in the electrotactic movement, still very little is known regarding the general mechanisms used by cells to detect such small EFs and to respond to them by directed translocation. In particular, no single sensor of the EF employed in electrotaxis has been identified. One possible reason is that such single sensor does not exist and the electrotactic reaction has a bi- or multimodal character. Two main hypotheses on the mechanism of electrotaxis are based either on activation of specific ion channels or on redistribution of cell membrane receptors responsible for sensing of directional signals from chemokines/growth factors on the cell surface. Since both mentioned above mechanisms are in fact not mutually exclusive, we suggest here the biphasic mechanism of electrotaxis and a complementary role of ion channels and chemoattractant receptors in this process. Our hypothesis assumes that the activity of ion channels is necessary for the first very fast cell reaction but after a sufficiently long time (a time scale of the order of dozen minutes) redistribution of receptors on the cell membrane may be sufficiently clear to be responsible for directing cell migration in the electric field.
To verify this hypothesis, we are going: (1) to characterize the dynamics of electrotactic reaction of mouse 3T3 fibroblasts, (2) to identify ion channel genes that are crucial in the electrotaxis of 3T3 cells by a screening strategy for the electrotaxis phenotype, (3) to identify genes of chemoattractants/growth factors receptors that are necessary for efficient electrotaxis of 3T3 cells (4) to prove that identified ion channels are necessary only for the first, very fast, reaction of cells for the EF and chemoattractant receptors redistribution for the second part of reaction observed after a prolonged time.
We think that our model may allow explanation of some valid questions concerning the mechanism of electrotaxis. Moreover, the results will be beneficial also for regenerative medicine, as endogenous dcEFs and electrotaxis play a significant role in wound healing and tissue regeneration. Since, the detailed understanding of signaling pathways regulating electrotaxis is crucial for establishing an efficient treatment in several disorders, the results of our project will be of high importance not only for science, but also for the entire society.
Przedmiotem projektu jest opracowanie innowacyjnego leku do zastosowania w leczeniu zwłóknienia narządów. Zwłóknienie narządów, zwane inaczej fibrozą jest patologicznym stanem wynikającym z nieprawidłowego gojenia się tkanek i może dotyczyć różnych narządów, włączając serce, płuca, trzustkę, wątrobę, nerki i skórę. Dochodzi wówczas do nadmiernego odkładania się substancji usztywniających w tkankach, a w konsekwencji do upośledzenia funkcjonowania całego organu. Szacuje się, że choroby zwłóknieniowe stanowią aż 45% wszystkich przypadków zgonów na świecie. Jak dotychczas, nie opracowano jednak skutecznego lekarstwa na tę chorobę. Celem niniejszego projektu jest opracowanie innowacyjnego leku na zwłóknienie narządów, o wydłużonym czasie działania w żywym organizmie.
Molekularne i komórkowe mechanizmy pro-regeneracyjnego działania pęcherzyków zewnątrzkomórkowych (EVs) z komórek macierzystych w uszkodzeniach niedokrwiennych serca: Rola microRNAs Pęcherzyki zewnątrzkomórkowe (EVs) stanowią frakcję obłonionych submikronowych struktur zawierających fragment cytoplazmy komórki, z której powstają i mogą być wydzielane przez żywe komórki różnych rodzajów, w tym ludzkie komórki macierzyste (SCs). Intensywność badań EVs znacząco wzrosła w ostatnim czasie, zwracając szczególnie uwagę na ich aktywność w komunikacji międzykomórkowej, za którą odpowiedzialne są bioaktywne cząsteczki przenoszone przez pęcherzyki pomiędzy komórkami, co wpływa na funkcje komórek docelowych. Rosnąca liczba badan światowych wskazuje, że EV wydzielane przez różne typy komórek macierzystych przenoszą ich bioaktywną zawartość do innych, bardziej dojrzałych komórek i w ten sposób uczestniczą w naprawie tkankowej, w tym niedokrwionego mięśnia sercowego. W związku z tym, że różne frakcje komórek macierzystych wydzielają pęcherzyki o różnym składzie molekularnym, prowadzone badania koncentrują się obecnie na poznaniu biologicznej i regeneracyjnej aktywności takich frakcji, w tym EVs wydzielanych przez indukowane pluripotencjalne komórki macierzyste (iPSCs) oraz komórki macierzyste mezenchymalne (MSCs), które stanową frakcję SCs izolowanych z dojrzałych tkanek, w tym szpiku kostnego, tkanki tłuszczowej oraz sznura pępowinowego. Badania naszego zespołu wykazały, że zarówno pęcherzyki wydzielane przez komórki iPSCs (iPSC-EVs), jak również MSCs (MSC-EVs) przenoszą szereg bioaktywnych cząsteczek odzwierciedlających skład molekularny komórek, które je wydzielają, w tym białka, cząsteczki mRNA oraz małe regulatorowe cząsteczki RNA – tzw. microRNA (miRNA), które pełnią istotną rolę w regulacji szeregu genów w komórkach. Co ciekawe, w naszych badaniach zaobserwowaliśmy także, że molekularna zawartość pęcherzyków może być przenoszona do komórek serca i wpływać na ich funkcje w warunkach in vitro oraz po przeszczepieniu in vivo. Pomimo tego, że zaobserwowano, że obie badane frakcje EVs wykazują aktywność proregeneracyjną w tkance serca, przenoszą one jednak inną zawartość molekularną, w tym całe grupy miRNA, które w różny sposób mogą regulować funkcje różnych typów komórek obecnych w sercu, co nie było do tej pory szczegółowo badane. Aby lepiej poznać mechanizmy stojące u podstaw obserwowanej aktywności proregeneracyjnej badanych frakcji EVs, w niniejszym projekcie zajmiemy się badaniem roli wybranych cząsteczek miRNA przenoszonych przez te pęcherzyki, w różnych typach komórek tkanki serca, zarówno w warunkach in vitro, jak i in vivo. W tym celu wykorzystamy strategię molekularną polegającą na wyciszeniu ekspresji wybranych cząsteczek miRNA, aby zbadać własności biologiczne tak zmodyfikowanych EVs oraz ich wpływ na molekularne i komórkowe funkcje komórek serca. Wyniki projektu dostarczą nam nie tylko nowej wiedzy w zakresie mechanizmów proregeneracyjnego działania różnych typów pęcherzyków produkowanych przez komórki macierzyste, ale mogą również potencjalnie otworzyć nowe perspektywy działań mających na celu poprawę regeneracji tkanek serca u pacjentów po uszkodzeniu niedokrwiennym.
Fibrosis is a pathological condition of the unbalanced extracellular matrix remodelling, estimated to contribute up to 45% of all deaths in the developed countries. Diseases of the exocrine pancreas represent some of the most dramatic examples of tissue fibrosis with deadly implications. In pancreatic cancer, fibrotic stroma severely limits the delivery of drugs to the tumour, directly protecting it against chemotherapy. In chronic pancreatitis, a necrotising disease of the pancreas, living components of the tissue become destroyed and replaced by a fibrotic scar. Although the vast majority of the exocrine pancreas consists of enzyme storing pancreatic acinar cells (PACs), pancreatic fibrosis is attributed to pancreatic stellate cells (PSCs), which constitute as little as 4-7% of all cells in the organ.
Normally quiescent and seemingly redundant, pancreatic stellate cells become activated upon tissue damage or in response to inflammatory mediators, such as TGF-β. Although these star-shaped cells are clearly required for tissue repair, in pancreatic disorders activated PSCs become “the villains” engaged in the overproduction of extracellular matrix components that replace live pancreatic tissue leading to dysfunction of the organ.
Excessive alcohol consumption, one of the most serious global problems of our modern society, is the major cause of chronic pancreatitis and pancreatic fibrosis. The products of alcohol metabolism, reactive oxygen species (ROS) and fatty acid ethyl esters (FAEEs), were shown to induce pathological Ca2+ signals in PACs, triggering premature activation of digestive enzymes in these cells, followed by autodigestion of the tissue, necrosis and inflammation. Our preliminary data show that alcohol metabolites also induce pathological Ca2+ signals in PSCs and that there is an astonishing reduction of these signals upon PSC activation with TGF-β. This resistance to alcohol metabolites is at least partially due to the shifts in the components of intracellular Ca2+ homeostasis upon PSC activation. The main goal of this project is to investigate the alterations in physiology of quiescent vs activated PSCs and to understand what causes those differences.
To achieve this, we plan to conduct a series of real-time intracellular Ca2+ measurements to compare Ca2+ signals induced by alcohol metabolites in quiescent and activated PSCs. This will be followed by analysis of shifts in Ca2+ homeostasis, i.e. comparing the intracellular Ca2+ store content and the mechanisms of Ca2+ fluxes across the plasma membrane in activated PSCs. Since Ca2+ homeostasis is tightly associated with the cellular redox balance, mitochondria and cell death, we will conduct a series of experiments to compare mitochondrial functions, ROS signals and the extent of cell death caused by ethanol metabolites in quiescent vs activated PSCs. In order to understand why activated PSCs are so different from quiescent PSCs, we plan to compare the transcriptome and proteome of these cells. The focus will be placed on Ca2+ channels and proteins controlling programmed cell death. Further, we will use confocal Raman spectroscopy to investigate characteristic biochemical shifts present in activated PSCs, which could be used as markers of PSC activation in future studies and diagnostics. Finally, we will test whether the alterations in gene / protein expression found in activated PSCs in vitro, also occur in vivo in a mouse model of alcohol-induced chronic pancreatitis
Although this is a typical basic research project expected to deliver novel insights into the pathophysiology of PSCs, the new knowledge obtained in this study might contribute to the development of new therapeutic procedures or medical policies for alcohol-induced pancreatitis or pancreatic cancer. Transcriptome analysis of PSCs will provide us with a large amount of data and will be made available for future research; whereas biochemical characteristics of activated PSCs revealed by spectroscopic methods might be used as templates for machine learning algorithms in automated histopathological assessment of collected tissues / biopsies.
Astma oskrzelowa uznawana jest za chorobę cywilizacyjną, którą zdiagnozowano już u ok. 300 milionów ludzi na świecie. Powoduje śmierć u co 250 chorego. Choć powszechnie uznaje się, że jej podłoże stanowi przewlekły stan zapalny współistniejący ze zmianami w strukturze ścian drzewa oskrzelowego, to jednak doniesienia ostatnich kilku lat wskazują, że oba te procesy w wielu przypadkach przebiegają wręcz niezależnie. Przebudowa ścian dróg oddechowych (obserwowana w każdym z wielu fenotypów astmy) prowadzi do upośledzenia funkcji oskrzeli spowodowanych w znacznym stopniu postępującym i niekontrolowanym zwłóknieniem podnabłonkowym (fibrozą). Zjawisko to ma zatem ogromne znaczenie kliniczne oraz stanowi bodziec do podejmowania badań podstawowych mających na celu poznanie i doprecyzowanie mechanizmów leżących u jego podstaw. Kluczowym zjawiskiem w rozwoju zwłóknienia podnabłonkowego oskrzeli pacjentów chorych na astmę jest występowanie licznej populacji miofibroblastów – komórek nadaktywnych kurczliwie i sekrecyjnie (wydzielają głównie białka macierzy zewnątrzkomórkowej). Wskutek relatywnie wysokiego stężenia miejscowo uwalnianych cytokin i/lub stymulacji mechanicznej przez mikrośrodowisko tkanki, fibroblasty ścian oskrzeli zmieniają swój profil fenotypowy przechodząc w miofibroblasty (FMT). Wiąże się to ze wzrostem ekspresji izoformy α-aktyny mięśni gładkich (α-SMA) zlokalizowanej głównie w rozbudowanej sieci włókien naprężeniowych zakotwiczonych w tzw. superdojrzałych kontaktach zogniskowanych (sFA). Według najbardziej aktualnej wiedzy efektywność programu FMT warunkowana jest wieloczynnikowo, gdzie swój udział mają także czynniki epigenetyczne. Niewiele jednak wiadomo na temat ich roli (zwłaszcza roli deacetylaz histonowych, HDAC) w indukcji/regulacji FMT. Dostępne źródła literaturowe opisują rolę niektórych HDAC w progresji licznych chorób, np. nowotworów lub innych niż astma chorób układu oddechowego (idiopatyczne zwłóknienie płuc, polipowatość błony śluzowej nosa). Badania przewidziane w tym projekcie mają na celu określenie roli mechanizmów epigenetycznych opartych o aktywność HDAC w indukcji programu FMT w modelu opartym o populacje ludzkich fibroblastów oskrzelowych (HBF) izolowanych z bioptatów pobranych od pacjentów chorych (AS) oraz osób niechorujących na astmę (NA). Niewątpliwym atutem tego modelu jest bezpośrednie pochodzenie komórek od pacjentów, co pozwala odnosić uzyskane wyniki in vitro do sytuacji in vivo. Przy obecnym stanie wiedzy astma oskrzelowa pozostaje nadal nieuleczalną chorobą, a z uwagi na specyfikę powszechnie stosowanych strategii leczenia astmy łagodzenie lub nawet cofnięcie przebudowy ścian oskrzeli może mieć ogromne znaczenie kliniczne. Dlatego doprecyzowanie molekularnych mechanizmów leżących u podstaw rozwoju astmy mogą umożliwić identyfikację nowych potencjalnych celów interwencji terapeutycznych.
Asthma - an unsolvable problem of modern medicine
Bronchial asthma is one of the most widespread chronic diseases - about 300 million people, and the incidence rate is constantly increasing. Unfortunately, it is treated only symptomatically, which is done mainly through the use of drugs (sympathomimetics) and medications that target inflammation, with little effect on inhibiting the remodeling of the bronchial tree wall and the structural changes that occur during the course of the disease.
Transformation of fibroblasts into myofibroblasts - friend or foe?
In the processes taking place in the bronchi, during the development of asthma, the whole spectrum of cells is involved: from immune cells, through epithelial cells (epithelia), smooth muscle cells, to the cells that form the stroma of the tissue - fibroblasts. In a healthy body, fibroblasts, or connective tissue cells, produce components of the extracellular matrix, which, in the form of an extracellular protein network, provides a scaffold for themselves and other cells in the tissue. This is also the case in healthy bronchi. However, as a result of prolonged inflammation going on in the airways and factors secreted by the cells during the course of asthma, fibroblasts are transformed into myofibroblasts. Fibroblasts, which once produced adequate amounts of extracellular matrix proteins, produce many more of them. Also synthesized isoform α of smooth muscle actin, a smooth muscle-specific protein that should not be present in fibroblasts. These characteristics support natural repair processes in the body, such as wound healing in the skin. However, in the bronchi, the long-term inflammatory process leads to many pathological changes in the structure of the bronchial wall called remodeling. One of its elements is the progressive fibrosis of the tissue under the epithelial layer. Excessive protein deposition causes the bronchial wall to thicken and stiffen, and the furnishing of fibroblasts with contractile proteins causes its contraction. This is associated with a loss of function of the bronchial tree exacerbating obstruction, which is an impairment of airflow caused by a reduction in bronchial lumen.
Can asthma be cured?
With the help of research into the mechanisms of phenotypic transitions come in vitro cell culture models developed by scientists from asthma patients and healthy individuals. They provide an opportunity to study the molecular mechanisms responsible for the aforementioned processes. Intracellular signaling pathways associated with the transforming growth factor β (TGF-β) signalling pathway, whose secretion is increased during inflammation in asthma, are mainly responsible for their regulation in asthma. Preliminary studies confirm that the pro-fibrotic signalling pathway is particularly enhanced in asthma. At the same time, the pathway that acts anti-fibrotic is impaired. It has been experimentally proven that the balance between the aforementioned pathways can be modulated at the molecular level toward both enhancing and attenuating fibrotic changes. However, the bronchial wall tissue includes many types of cells, and it is generally believed that pathological changes in the remodeling process start from the layer of the bronchial wall in contact with the environment, i.e. the epithelium. Still, the interactions between cells in the bronchial tissue where inflammation is taking place have not been studied. Learning about in vitro models for studying the interaction between epithelial cells and fibroblasts during an internship at Maastricht University will allow us to expand our ongoing research to include aspects of intercellular interactions. Among other things, the influence of bronchial epithelia from asthmatics on the transformation of fibroblasts into myofibroblasts in asthma will be studied, as well as its inter- and intracellular regulation at the molecular level in the different cell types. Understanding the molecular mechanisms of phenotypic transformation of fibroblasts into myofibroblasts, may provide the basis for the search for effective therapeutic strategies for asthma. The results of the experiments conducted within the framework of this innovative project carried out by the author may in the future find application in the study of substances that effectively eliminate fibrotic lesions in the bronchi.
Excessive alcohol consumption is one of the biggest global problems. Among its many detrimental effects it can activate tissue remodelling in the pancreas, known as pancreatic fibrosis. Soft pancreatic tissue becomes then destroyed and replaced by a fibrotic scar leading to malnutrition and diabetes. This project aims to investigate the mechanisms that underlie the process of fibrosis from fundamental signalling events in single cells to pathological changes in the tissue. Real time imaging techniques will be applied to measure alcohol-induced spatiotemporal intracellular calcium signals and their role in triggering pancreatic fibrosis. New animal models of alcoholic pancreatitis combined with histological methods, immunofluorescence and confocal Raman microspectroscopy will allow tracing the progress of the disease in its different stages. This project aims to deliver a novel strategy against fibrosis targeting its cellular mediators.
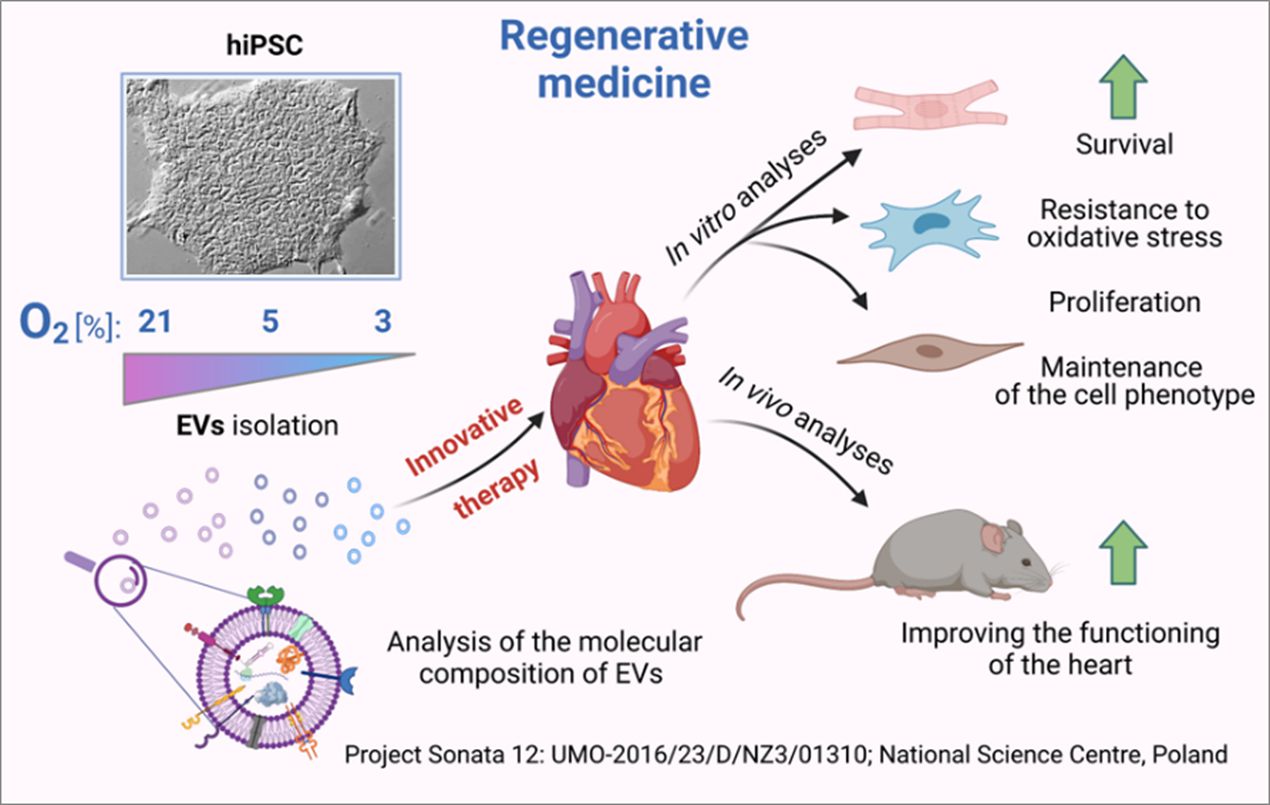
Regeneration of tissues and organs still remains a great challenge for modern medicine. Due to the inability or limited potential to restore functionality of damaged organs in humans, e.g. the heart muscle, innovative therapeutic methods are needed. In this respect, stem cells (SC)-based therapies appear to be particularly promising. SCs possess a naïve - undifferentiated phenotype and can differentiate into other types of cells upon stimulation with certain factors. A particular type of SC are induced pluripotent stem cells (iPSC), which carry the ability to differentiate into any type of cell in the human body and can be maintained indefinitely in culture. Because iPSCs are artificially created in a laboratory, their use in biomedical research does not raise any ethical issues. Thus, iPSCs are an excellent tool for disease modeling or drug testing. They also constitute a potential source of effector cells for repair of damaged organs. Moreover, iPSCs, like other cells, secrete bioactive nanostructures, so called extracellular vesicles (EVs). EVs are tiny vesicles which contain bioactive components, such as proteins, lipids and RNA molecules. Upon entering other cells, EVs release their cargo, which may change behavior and functionality of the recipient cells. Therefore, the use of both iPSCs and EVs is an attractive tool in regenerative medicine.
First, we investigated the molecular composition of hiPSC and hiPS-EVs using modern research methods. Second, we tested the functional effects of hiPS-EVs derived from various oxygen concentrations on cells that build the human heart, including cardiomyocytes (contractile cells), cells of the blood vessels and stromal cells. Finally, we examined the regenerative ability of hiPS-EVs directly in a living organism, using a mouse model of heart injury (Fig. 1). The obtained results indicate that the molecular signature of both hiPSC and hiPS-EVs is highly influenced by the oxygen availability in the cellular environment. Such changes also affect the biological activity of hiPS-EVs. The treatment of heart cells with hiPS-EVs showed beneficial effects, including improvement of cell survival, resistance to oxidative stress, increased proliferation and the maintenance of cell phenotype. Importantly, the studies of heart damage in experimental mice confirmed the beneficial effect of hiPS-EVs-based therapy, paving the way for innovative approaches in contemporary medicine
Importantly, the natural environment in which SCs reside, is characterized by a reduced oxygen availability (called hypoxia), in contrast to the atmospheric oxygen concentration (termed normoxia). However, the influence of hypoxia on the biological properties of human iPSCs (hiPSC) and their EVs is not fully understood, which was the main research goal of the project.Summarizing, the results obtained in this project provided new insight into the effects of oxygen concentration in the hiPSC microenvironment on the molecular composition and metabolism of iPSCs and the activity of hiPS-EVs. The positive impact of iPS-EVs on the functioning of heart cells, proven in this project, can be harnessed for the purposes of regenerative medicine, including experimental cardiology. Thus, results obtained in this project may contribute to the improvement of the health of many patients in the future.
Projekt będzie realizowany w ramach konsorcjum BioMiStem, w skład którego wchodzą: Uniwersytet Jagielloński (lider), Akademia Górniczo-Hutnicza im. Stanisława Staszica w Krakowie, Instytut Technologii Materiałów Elektronicznych w Warszawie, Uniwersytet Medyczny w Lublinie, Instytut Farmakologii PAN w Krakowie, Instytut Zootechniki - Państwowy Instytut Badawczy w Krakowie oraz Instytut Medycyny Innowacyjnej Sp. z o.o. w Krakowie.
Badania na Uniwersytecie Jagiellońskim będą prowadzone przede wszystkim na Wydziale Biochemii, Biofizyki i Biotechnologii (Zakład Biologii Komórki), a także na Wydziale Chemii (Zakład Chemii Fizycznej i Elektrochemii) i w Małopolskim Centrum Biotechnologii (Laboratorium Biotechnologii Komórek Macierzystych).
Kierownikiem projektu, którego wartość całkowita wynosi ponad 17 mln złotych, jest dr hab. Ewa Zuba-Surma, prof. UJ z Zakładu Biologii Komórki Wydziału Biochemii, Biofizyki i Biotechnologii UJ.
Choroby cywilizacyjne oraz towarzyszące im między innymi schorzenia narządu ruchu stanowią wyzwanie współczesnej medycyny regeneracyjnej. Projekt badawczy zakłada wykorzystanie biozgodnych materiałów jako rusztowań dla mezenchymalnych komórek macierzystych (MSCs) oraz ich wykorzystania w regeneracji tkanki chrzęstnej i kostnej u pacjentów cierpiących na choroby cywilizacyjne, takie jak otyłość i cukrzyca typu 2. Opracowanie innowacyjnych rusztowań dla komórek o potencjale regeneracyjnym będą przedmiotem badań podstawowych, przemysłowych oraz prac rozwojowych. Międzydziedzinowa współpraca pomiędzy poszczególnymi ośrodkami naukowo-badawczymi i partnerem biznesowym daje szansę na poznanie mechanizmów regeneracji oraz opracowanie nowych metod leczenia, w tym uszkodzeń tkanki kostnej i chrzęstnej u pacjentów z chorobami cywilizacyjnymi.
Projekt będzie realizowany w ramach konsorcjum BioMiStem, w skład którego wchodzą: Uniwersytet Jagielloński (lider), Akademia Górniczo-Hutnicza im. Stanisława Staszica w Krakowie, Instytut Technologii Materiałów Elektronicznych w Warszawie, Uniwersytet Medyczny w Lublinie, Instytut Farmakologii PAN w Krakowie, Instytut Zootechniki - Państwowy Instytut Badawczy w Krakowie oraz Instytut Medycyny Innowacyjnej Sp. z o.o. w Krakowie.
Badania na Uniwersytecie Jagiellońskim będą prowadzone przede wszystkim na Wydziale Biochemii, Biofizyki i Biotechnologii (Zakład Biologii Komórki), a także na Wydziale Chemii (Zakład Chemii Fizycznej i Elektrochemii) i w Małopolskim Centrum Biotechnologii (Laboratorium Biotechnologii Komórek Macierzystych).
Kierownikiem projektu, którego wartość całkowita wynosi ponad 17 mln złotych, jest dr hab. Ewa Zuba-Surma, prof. UJ z Zakładu Biologii Komórki Wydziału Biochemii, Biofizyki i Biotechnologii UJ.
Choroby cywilizacyjne oraz towarzyszące im między innymi schorzenia narządu ruchu stanowią wyzwanie współczesnej medycyny regeneracyjnej. Projekt badawczy zakłada wykorzystanie biozgodnych materiałów jako rusztowań dla mezenchymalnych komórek macierzystych (MSCs) oraz ich wykorzystania w regeneracji tkanki chrzęstnej i kostnej u pacjentów cierpiących na choroby cywilizacyjne, takie jak otyłość i cukrzyca typu 2. Opracowanie innowacyjnych rusztowań dla komórek o potencjale regeneracyjnym będą przedmiotem badań podstawowych, przemysłowych oraz prac rozwojowych. Międzydziedzinowa współpraca pomiędzy poszczególnymi ośrodkami naukowo-badawczymi i partnerem biznesowym daje szansę na poznanie mechanizmów regeneracji oraz opracowanie nowych metod leczenia, w tym uszkodzeń tkanki kostnej i chrzęstnej u pacjentów z chorobami cywilizacyjnymi.
Ogromnym wyzwaniem dla współczesnej medycyny jest regeneracja tkanek i narządów. Ze względu na brak możliwości lub ograniczony potencjał do odtworzenia funkcjonalnej struktury uszkodzonych tkanek u człowieka, np. mięśnia sercowego, poszukuje się nowatorskich metod terapeutycznych. W tym zakresie, metody oparte o komórki macierzyste (ang, stem cells; SC), wydają się szczególnie obiecujące. SC posiadają pierwotny – niezróżnicowany charakter i pod wpływem określonych czynników, mogą różnicować w inne typy komórek. Szczególnym rodzajem SC są indukowane pluripotencjalne komórki macierzyste (ang. induced pluripotent stem cells; iPSC), które posiadają zdolność do różnicowania we wszystkie rodzaje komórek budujących organizm dorosły oraz można je utrzymać w hodowli w nieskończoność. iPSC są komórkami sztucznie utworzonymi w laboratorium, dlatego ich wykorzystanie w badaniach biomedycznych nie wzbudza kontrowersji etycznych. Stąd też, iPSC są doskonałym narzędziem do modelowania chorób czy testowania nowych leków oraz stanowią potencjalne źródło komórek do przeszczepów i naprawy uszkodzonych narządów. Co więcej, iPSC, podobnie jak inne komórki, wydzielają bioaktywne nanostruktury, w postaci pęcherzyków zewnątrzkomórkowych (ang. extracellular vesicles; EVs). EVs to maleńkie pęcherzyki, które zawierają bioaktywne składniki, takie jak białka, lipidy i cząsteczek RNA. EVs mogą wnikać do innych komórek i po uwolnieniu swojej zawartości, mogą zmieniać zachowanie oraz sposób funkcjonowania komórek docelowych. Zatem wykorzystanie zarówno komórek iPSCs, jak i EVs stanowi atrakcyjne narzędzie w medycynie regeneracyjnej. Co ważne, naturalne środowisko występowania SCs cechuje obniżona dostępność tlenu (tzw. hipoksja), w porównaniu do wartości atmosferycznego stężenia tlenu (tzw. normoksja). Jednak wpływ hipoksji na właściwości biologiczne ludzkich iPSCs (hiPSCs) oraz wydzielanych przez nie EVs nie został w pełni poznany, co stanowiło główny cel badawczy projektu.
Wykorzystując nowoczesne metody badawcze, sprawdziliśmy w projekcie skład molekularny hiPSC oraz pochodzących z nich EVs. Zbadaliśmy również wpływ hiPS-EVs pochodzących z różnych warunków stężenia tlenu, na różne rodzaje komórek mięśnia sercowego, włączając kardiomiocyty (komórki kurczliwe) komórki budujące ściany naczyń krwionośnych oraz komórki stromalne. Co więcej, dokonaliśmy weryfikacji terapeutycznych właściwości hiPS-EVs bezpośrednio w modelu mysim uszkodzenia serca (Ryc. 1). Uzyskane wyniki wskazują, że w zależności od dostępności tlenu w hodowli, zachodzą zmiany na poziomie molekularnym, zarówno w komórkach, jak i EVs, co również przekłada się na aktywność biologiczną EVs. Wykazaliśmy korzystne działanie hiPS-EVs na różne populacje komórek serca, w tym zwiększenie przeżywalności, wzrost odporności na stres oksydacyjny, wzmożoną proliferację oraz zachowanie fenotypu komórkowego. W badaniach uszkodzenia serca u myszy doświadczalnych potwierdziliśmy korzystny wpływ zastosowania terapii w oparciu o hiPS-EVs.
Podsumowując, wyniki uzyskane w projekcie dostarczyły nowej wiedzy na temat wpływu stężenia tlenu w mikrośrodowisku komórek hiPSC na skład molekularny oraz metabolizm hiPSC oraz aktywność wydzielanych przez nie EVs. Co ważne, potwierdzony w projekcie korzystny wpływ hiPS-EVs na funkcjonowanie komórek serca może zostać wykorzystany w medycynie regeneracyjnej, włączając kardiologię eksperymentalną. Dzięki temu, uzyskane rezultaty mogą przyczynić się do poprawy zdrowia wielu pacjentów.

