W Zakładzie Biologii Komórki od wielu lat prowadzimy badania różnych aspektów migracji komórek zarówno nowotworowych jak i prawidłowych. Dysponujemy unikalnym, autorskim, zestawem metod komputerowych służących analizie tego zjawiska, jak również zestawem nowoczesnych układów do mikroskopii przyżyciowej, dedykowanych rejestracji ruchu komórek w odpowiednich warunkach środowiskowych, zarówno w świetle przechodzącym jak i z zastosowaniem epifluorescencji.
Osoby zaangażowane w realizację tematyki w ZBK: prof. dr hab. Jarosław Czyż, prof. dr hab. Justyna Drukała, dr hab. Marta Michalik, prof. UJ, dr Sławomir Lasota, dr Katarzyna Piwowarczyk, dr Milena Paw, dr Dawid Wnuk
Komórki biorące udział w takich procesach biologicznych jak embriogeneza, gojenie ran i regeneracja tkanek bardzo często muszą wykazywać zdolność do kierunkowej migracji w celu dotarcia do tych miejsc organizmu, w których mają wypełnić swoje funkcje biologiczne. Jednym z licznych przykładów takiej aktywności może być migracja komórek w kierunku wzrastającego stężenia chemoatraktanta w obrębie tkanki w trakcie procesu gojenia ran. Nie jest to jedyny znany mechanizm naprowadzania kierunkowego migrujących w czasie tego procesu komórek. Wiadomo, że komórki mogą również odpowiadać kierunkową migracją na inne sygnały, takie jak gradient adhezyjności podłoża bądź jego topografia i sztywność. Jednak jednym z pierwszych kierunkowych sygnałów, który pojawia się natychmiast po zranieniu jest stałe pole elektryczne. Obecność endogennych pól elektrycznych (PE) w przestrzeni zewnątrzkomórkowej była po raz pierwszy stwierdzona już ponad 150 lat temu, jednakże ich znaczenie dla licznych procesów fizjologicznych zostało potwierdzone dopiero w ostatnim czasie, w wyniku zastosowania wielu nowoczesnych metod badawczych. Kilka niezależnych prac potwierdziło, że pola elektryczne są formowane we wszystkich rozwijających się i regenerujących tkankach zwierzęcych i odgrywają istotną rolę w kluczowych procesach biologicznych, takich jak embriogeneza, gojenie ran i regeneracja tkanek. Większość organów i zarodków otoczonych przez warstwę komórek nabłonkowych wytwarza potencjał transepitelialny rzędu od kilku do kilkudziesięciu miliwoltów. Głównym efektem działania PE na poziomie komórkowym jest elektrotaksja, czyli kierunkowa migracja w kierunku katody lub anody. Warto zwrócić uwagę, że taka aktywność ruchowa jest zupełnie odmienna od pasywnego przemieszczenia nieożywionych cząsteczek pod wpływem czysto fizycznych oddziaływań, gdyż komórki odpowiadają na pole elektryczne aktywną kierunkową migracją!
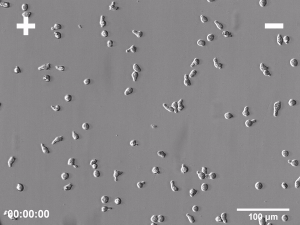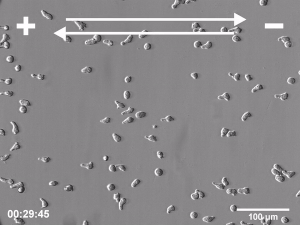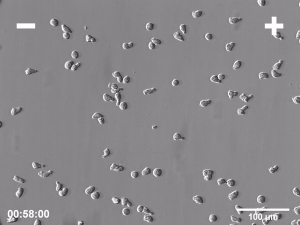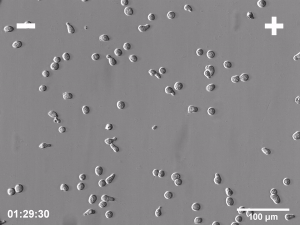
Pola elektryczne o natężeniu zbliżonym do obserwowanego in vivo aplikowane w warunkach in vitro indukują elektrotaksję licznych typów komórek. Jednakże, pomimo wieloletnich badań, wciąż nieznany pozostaje mechanizm wykorzystywany przez komórki do detekcji tak niewielkich pól elektrycznych i kierunkowej migracji w odpowiedzi na ich obecność. Do chwili obecnej zaproponowano kilka potencjalnych mechanizmów reakcji elektrotaktycznej. Jednak żaden z nich nie tłumaczy w pełni wszystkich poczynionych obserwacji dotyczących przebiegu tego zjawiska. W szczególności żaden pojedynczy sensor PE wykorzystywany w elektrotaksji nie został poznany. Jednym z możliwych powodów takiego stanu rzeczy może być brak takiego pojedynczego sensora i dwu- lub wielomodalny charakter reakcji elektrotaktycznej. Dwie główne hipotezy wyjaśniające mechanizm elektrotaksji opierają się bądź na mechanizmie zakładającym aktywację specyficznych kanałów jonowych przez pole elektryczne, bądź redystrybucję zlokalizowanych na powierzchni komórki błonowych receptorów odpowiedzialnych za reakcję na kierunkowe sygnały pochodzące od chemokin lub czynników wzrostowych. Jako, że oba wspomniane powyżej mechanizmy w rzeczywistości nie wykluczają się wzajemnie, możliwe jest również ich współdziałanie występowanie dwufazowego mechanizmu elektrotaksji w oparciu o komplementarną rolę kanałów jonowych oraz receptorów dla chemoatraktantów.
Badania elektrotaksji prowadzone w ZBK wykazały m.in. znaczenie dla tego procesu zależnych od napięcia kanałów potasowych oraz dokomórkowych prostowniczych kanałów potasowych Kir, niezwykle szybką dynamikę reakcji na pole elektryczne komórek Amoeba Proteus, reakcję elektrotaktyczną zarówno komórek migrujących z zastosowaniem strategii mezenchymalnej ruchu jak i strategii ameboidalnej jak również znaczenie pola endogennego pola elektrycznego w ukierunkowanej migracji mezenchymalnych komórek macierzystych w procesie gojenia rany.
Kierownik tematu: prof. dr hab. Zbigniew Madeja
Osoby zaangażowane w realizację tematyki w ZBK: dr Sławomir Lasota
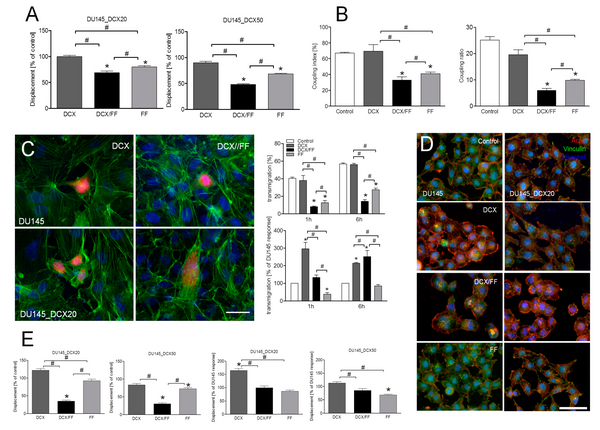
Elementy kompleksu powierzchniowego, na który składają się receptory macierzy zewnątrzkomórkowej i adhezji międzykomórkowej wraz z systemem białek zaangażowanych w interakcje z cytoszkieletem decydują o integralności mechanicznej wielu tkanek. Zostały one również zidentyfikowane, jako czynniki zaangażowane w transformację nowotworową i rozwój nowotworów. W Zakładzie prowadzone są badania funkcji kompleksu powierzchniowego złożonego z receptorów adhezji komórka-macierz zewnątrzkomórkowa (np. integryn), adhezji międzykomórkowej (np. kadheryn) i złączy szczelinowych (zbudowanych z koneksyn) w toku progresji nowotworu i jego potencjalnego udziału w tworzeniu przerzutów przez komórki nowotworowe (więcej o temacie w publikacji: https://doi.org/10.3390/cancers10100363).
Kierownik tematu: prof. dr hab. Jarosław Czyż
Osoby zaangażowane w realizację tematyki w ZBK: dr Katarzyna Piwowarczyk, dr Milena Paw
Brak przełomu w rozwoju nowych, skuteczniejszych strategii leczenia niektórych chorób przewlekłych, w tym nowotworów i astmy, skłania do poszukiwania niestandardowych rozwiązań w walce z tymi chorobami. Blokery metaboliczne są grupą związków mogących hamować rozwój nowotworów i astmy poprzez interferencję z metabolizmem komórkowym. Należą do nich np. fibraty, które pierwotnie zostały zakwalifikowane do walki z hiperlipidemią. Badania prowadzone w Zakładzie dotychczas pokazały, że fenofibrat, który jest jednym z powszechniej stosowanych fibratów, ogranicza zarówno rozwój frontu inwazyjnego i kaskadę metastatyczną nowotworów (link do publikacji: https://doi.org/10.3390/cancers11010077), jak i progresję astmy (link do publikacji: https://doi.org/10.3390/ijms19092571). Prowadzone badania skoncentrowane są na analizach potencjału przeciwnowotworowego i przeciwastmatycznego fibratów obecnie wprowadzanych na rynek farmaceutyczny.
Kierownik tematu: prof. dr hab. Jarosław Czyż
Osoby zaangażowane w realizację tematyki w ZBK: dr hab. Marta Michalik prof. UJ, dr Katarzyna Piwowarczyk, dr Milena Paw, dr Dawid Wnuk
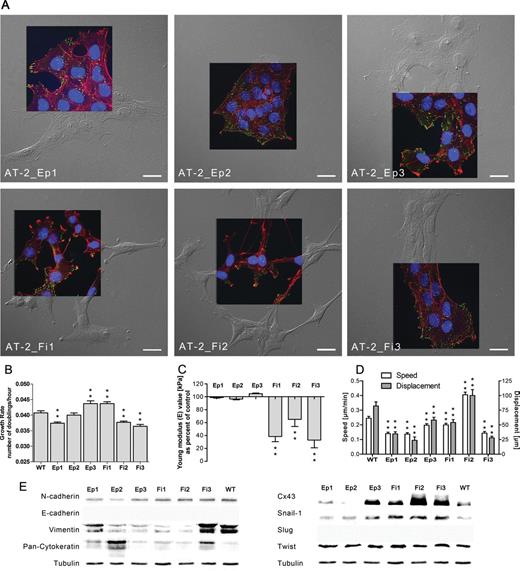
Mikroewolucja fenotypowa komórek nowotworowych jest „motorem” rozwoju nowotworów, jednocześnie decydując o ich cechach przystosowawczych. Proces ten odpowiada m. in. za rozwój lekooporności nowotworów i niepowodzenia chemioterapii, a w wyniku powiązań między lekoopornością i inwazyjnością komórek nowotworowych, może też może też wzmagać potencjał metastatyczny komórek budujących guzy. W Zakładzie prowadzone są badania mechanizmów i skutków mikroewolucji fenotypowej komórek nowotworowych indukowanej przez cytostatyk, blokery metaboliczne i substancje fitoaktywne, w tym roli komórek macierzystych w tym procesie (link do publikacji: https://doi.org/10.1002/stem.3281). W tym kontekście badane jest również zaangażowanie białek z rodziny koneksyn w regulację powiązań między inwazyjnością, lekoopornością i profilem metabolicznym komórek (link do publikacji: https://doi.org/10.1093/carcin/bgu033).
Kierownik tematu: prof. dr hab. Jarosław Czyż
Osoby zaangażowane w realizację tematyki w ZBK: dr Katarzyna Piwowarczyk, mgr Maciej Pudełek
Inżynieria tkankowa stanowi alternatywę dla konwencjonalnych metod leczenia ubytków tkanek wywołanych urazami lub chorobą nowotworową. Jej istota opiera się na wykorzystaniu hodowanych poza organizmem komórek ludzkich na nośniku, który imituje macierz pozakomórkową, typową dla danej tkanki. Ta dziedzina biotechnologii rozwija się już od ponad 20 lat, a stało się to możliwe dzięki opanowaniu metod izolacji i hodowli populacji komórek, wzbogaconych w komórki macierzyste, odpowiadających za regenerację tkanek. Optymalizacja izolacji i hodowli tych komórek z zachowaniem ich „niedojrzałego" fenotypu i wysokiego potencjału proliferacyjnego to cel badań wielu pracowni na świecie. Wiąże się to z badaniem biologii tych komórek, której poznanie i zrozumienie pozwoli na sterowanie procesami ich różnicowania i starzenia.
Jednym z pierwszych produktów inżynierii tkankowej są hodowane in vitro keratynocyty wykorzystywane od ponad 30 lat w przypadkach gdy zawodzą naturalne mechanizmy regeneracji skóry. Przeszczepy hodowanych in vitro keratynocytów stosuje się przede wszystkim w leczeniu rozległych oparzeń oraz chronicznych owrzodzeń. Zapewniają one szybkie i trwałe zabezpieczenie rany, długotrwałą skuteczność oraz dobry efekt kosmetyczny, związany z ograniczeniem bliznowacenia.
Nasze laboratorium GMP specjalizuje się w wytwarzaniu produktów inżynierii tkankowej skóry stosowanych w leczeniu rozległych oparzeń, głównie komórek naskórka, ale także komórek stromalnych, które w połączeniu z matrycą kolagenową istotnie pobudzają regenerację tkanki łącznej skóry właściwej. Ponadto przygotowujemy produkty z komórek mezenchymalnych do regeneracji tkanki łącznej w leczeniu przetok okołoodbytniczych i odbytniczo-pochwowych. Kolejny nasz produkt to chondrocyty wykorzystywane do leczenia chondromalacji. Nieustannie pracujemy nad udoskonalaniem strategii gojenia ran z wykorzystaniem komórek skóry i matryc acelularnych, prowadząc badania podstawowe w tym zakresie.
Wieloletnie doświadczenie Banku Komórek w opracowywaniu ATMP pozwala nam oferować usługi w zakresie wdrażania nowych wyników badań w dziedzinie ATMP do zastosowań klinicznych. Oprócz badań klinicznych, pracujemy nad nowymi źródłami komórek macierzystych naskórka, które po wykorzystaniu klinicznym pozwolą na uzyskanie pełnej regeneracji skóry wraz z jej przydatkami. Poza tym prowadzimy badania podstawowe poszukiwania różnego rodzaju markerów, w tym markerów odróżniających ekrynowe i apokrynowe pochodzenie przewodów gruczołów potowych.
Ponadto, wykorzystujemy hodowane in vitro komórki naskórka jako model do badania mechanizmów związanych z patologią łuszczycy i atopowym zapaleniem skóry we współpracy z grupą ze Szwajcarii.
Kierownik tematu: prof. dr hab. Justyna Drukała
Osoby zaangażowane w realizację tematyki w ZBK: mgr Joanna Stalińska, mgr Alicja Ślusarczyk, dr Milena Paw, dr Dawid Wnuk
Astma jest obecnie jedną z najczęstszych chorób dróg oddechowych i dotyka około 10% populacji ludzkiej. Zapaleniu występującemu w drogach oddechowych towarzyszą procesy uszkadzania i naprawy nabłonka oskrzeli, które powodują strukturalne i czynnościowe zmiany określane jako przebudowa ściany oskrzeli (ang. remodeling). Mimo intensywnych badań, w dalszym ciągu nie wiadomo, czy przebudowa oskrzeli jest tylko skutkiem przewlekłego zapalenia błony śluzowej, czy też jedną z przyczyn choroby. Cechą charakterystyczną oskrzeli osób chorych na astmę jest odkładanie składników macierzy pozakomórkowej bezpośrednio pod błoną podstawną, oraz pojawianie się dużej liczby miofibroblastów (komórek o fenotypie pośrednim między fibroblastami, a komórkami mięśni gładkich) w przylegającej warstwie siateczkowatej, co prowadzi do usztywnienia ściany oskrzeli. Według hipotezy Holgate'a i wsp. komórki nabłonkowe i fibroblasty błony śluzowej oskrzeli tworzą czynnościową „troficzną jednostkę epitelialno-mezynchymalną". Zgodnie z tą hipotezą, uraz nabłonka prowadzi do zwiększonego uwalniania mediatorów, które aktywują fenotypowe przejście fibroblastów w miofibroblasty (FMT) oraz zwiększają ekspresję i wydzielanie przez nie białek macierzy zewnątrzkomórkowej. Prowadzone w Zakładzie badania, wykorzystujące izolowane fibroblasty oskrzelowe poddawane działaniu różnych mediatorów pochodzenia epitelialnego, mają na celu wyjaśnienie roli nabłonka i fibroblastów w remodelingu oskrzeli. Zrozumienie procesu przebudowy oskrzeli może w przyszłości umożliwić podjęcie prób jego odwrócenia lub zahamowania przy użyciu nowych leków.
Badania dotyczą przede wszystkim:
- charakteru fenotypowego przejścia fibroblastów do miofibroblastów (FMT) i podstaw mechanizmów przebudowy ścian oskrzeli w astmie.
- różnic między astmatycznymi i nieastmatycznymi fibroblastami oskrzelowymi (HBFs) przy braku stymulacji oraz w odpowiedzi na stymulację transformującym czynnikiem wzrostu β (główna cytokina profibrotyczna) ze szczególnym uwgzlędnieniem sygnalizacji białek Smad w modelu 2D oraz w modelu hodowli in vitro w warunkach 3D.
- mechanizmów wzmożonego przejścia nabłonkowo-mezenchymalnego związanego z astmą oraz funkcjonalnych interakcji między ludzkimi komórkami nabłonka oskrzeli (HBEC) i HBF w obrębie nabłonkowo-mezenchymalnej jednostki troficznej (EMTU).
- zaangażowania komunikacji międzykomórkowej i kontaktów komórka-komórka ze szczególnym uwzględnieniem roli Cx43 w FMT
- roli wybranych szlaków niekanonicznych np. GSK-3β/β-katenina, szlak kinaz MAPK (p38) w FMT
- wpływu wybranych związków np. flawonoidów (m.in. apigeniny), statyn (lowastatyny, skwalestatyny itp.), chalkonów, agonistów PPAR (np. fenofibratu) na skuteczność FMT
Kierownik tematu: dr hab. Marta Michalik, prof. UJ
Osoby zaangażowane w realizację tematyki w ZBK: dr Milena Paw, dr Dawid Wnuk, prof. dr hab. Jarosław Czyż
Ostre i przewlekłe zapalenie trzustki, a także zwłóknienie i rak trzustki to choroby, które ze względu na brak skutecznych terapii pozostają aktualnym wyzwaniem klinicznym.
W zdrowej trzustce precyzyjnie kontrolowane oscylacje stężenia jonów wapnia w cytozolu komórek pęcherzykowych trzustki prowadzą do uwalniania nieaktywnych form enzymów trawiennych do kanalików trzustkowych, co chroni organ przed samostrawieniem. Wraz z sokiem trzustkowym nieaktywne enzymy (takie jak np. trypsynogen) trafiają do dwunastnicy, gdzie zachodzi ich sekwencyjna aktywacja. Rozregulowana sygnalizacja wapniowa - np. na skutek działania metabolitów etanolu lub soli kwasów żółciowych - powoduje przedwczesną aktywację trypsyny wewnątrz komórek pęcherzykowych, a tym samym nekrozę komórek, dalsze uwalnianie ich enzymatycznej zawartości i w konsekwencji samotrawienie organu, prowadzące do poważnego stanu zapalnego w obrębie jamy brzusznej, które może doprowadzić do niewydolności systemowej u pacjenta.
Procesy przewlekłego uszkodzenia trzustki wiążą się z bliznowaceniem i zwłóknieniem tkanki, za które odpowiedzialne są komórki stelarne, które przypominają klasyczne fibroblasty. Komórki te w zdrowej tkance stanowią zaledwie kilka procent wszystkich komórek. Jednakże przewlekły stan zapalny prowadzi do aktywacji komórek stelarnych, tzn. przejścia do fenotypu miofibroblastów, zdolnych do produkcji kolagenu i innych białek macierzy zewnątrzkomórkowej.
W przypadku przewlekłego zapalenia trzustki, które bardzo często jest skutkiem nadmiernej konsumpcji alkoholu, procesy zwłóknieniowe prowadzą do problemów związanych z zaburzonym trawieniem pokarmów i rozregulowaną gospodarką glukozową.
Komórki stelarne odgrywają również kluczową rolę w rozwoju guzów trzustki, a dokładniej w tzw. reakcji desmoplastycznej. Nadmierna produkcja białek macierzy zewnątrzkomórkowej przyczynia się do powstania charakterystycznej macierzy raka trzustki, która jest fizyczną barierą ograniczającą dostęp leków do komórek nowotworowych, a tym samym obniża skuteczność obecnie stosowanych terapii.
Nasze zainteresowania badawcze skupiają się na komórkowych mechanizmach sygnalizacyjnych leżących u podstaw powyższych procesów. Aktualnie realizujemy projekty mające na celu:
- Poznanie różnic fizjologicznych i bioenergetycznych pomiędzy niezaktywowanymi a zaktywowanymi komórkami stelarnymi trzustki.
- Zbadanie roli sygnalizacji wapniowej (zwłaszcza funkcji tzw. kanałów wapniowych) w procesie przejścia fenotypowego komórek stelarnych oraz w procesach prowadzących do włóknienia tkanki.
- Zrozumienie wpływu czynników promujących zwłóknienie trzustki (metabolity etanolu i kwasów tłuszczowych oraz nikotyna i jej pochodne) na biologię komórek stelarnych
- Określenie roli retinoidów w fizjologii komórek stelarnych trzustki.
- Wykorzystanie inhibicji białek z rodziny Bcl-2 jako mechanizmu regulującego śmierć komórek pęcherzykowych i stelarnych trzustki w stanach zapalnych trzustki.
- Pionierskie zastosowanie kombinowanej terapii przeciwko rakowi trzustki, celującej nie tylko w komórki nowotworowe, ale także w komórki stelarne trzustki.
Dzięki owocnej współpracy z innymi jednostkami UJ (Małopolskie Centrum Biotechnologii) oraz instytucjami uniwersyteckimi z Wielkiej Brytanii, Belgii i Chin, w naszej pracy wykorzystujemy szeroki wachlarz technik laboratoryjnych: od klasycznej biologii molekularnej i hodowli komórkowych, poprzez zaawansowane modele zwierzęce chorób trzustki, metody (immuno)histologiczne, mikroskopię fluorescencyjną i konfokalną, aż do spektroskopii Ramanowskiej i mikroskopii elektronowej.
Kierownik tematu: dr hab. Paweł Ferdek
Osoby zaangażowane w realizację tematyki w ZBK: mgr Agnieszka Kusiak – stypendystka w projekcie OPUS, mgr Jacek Litewka – stypendysta w projekcie OPUS,
Prace magisterskie wykonane w ramach prowadzonych badań:
- mgr Agnieszka Kusiak (2020) – stypendystka w projekcie HOMING
- lek. med. Mateusz Szopa (2020) – stypendysta w projekcie HOMING
- mgr inż. Katarzyna Fryt (2021) – stypendystka w projekcie OPUS
- mgr Maciej Garczyk (2022)
Współpracownicy z Małopolskiego Centrum Biotechnologii UJ:
- dr Monika Jakubowska
- mgr Kinga Stopa
- mgr Daria Krzysztofik
Finansowanie zewnętrzne:
07/2018-12/2021 – HOMING/2017-4/31 (Fundacja na Rzecz Nauki Polskiej): Targeting alcohol-induced pancreatic fibrosis – the role of pancreatic stellate cells, intracellular calcium signals and Bcl-2 family proteins. Alkoholowe zwłóknienie trzustki – rola komórek stelarnych, wewnątrzkomórkowych sygnałów wapniowych oraz białek z rodziny Bcl-2 (kierownik: Paweł Ferdek)
07/2020-06/2024 – OPUS nr 2019/33/B/NZ3/02578 (Narodowe Centrum Nauki): A star or a villain: why do pancreatic stellate cells turn “evil” after activation? Co sprawia, że zaktywowane komórki stelarne powodują zwłóknienie trzustki? (kierownik: Paweł Ferdek)
02/2022-02/2025 – PRELUDIUM nr 2021/41/N/NZ3/04320 (Narodowe Centrum Nauki): Mitochondria in activated pancreatic stellate cells – the engines of fibrosis? Alterations in mitochondria of pancreatic stellate cells and their implications in tissue pathophysiology. Zmiany w mitochondriach aktywowanych komórek stelarnych trzustki i ich implikacje w stanach patofizjologicznych tkanki. (kierownik: Agnieszka Kusiak, opiekun: Paweł Ferdek)
Finansowanie wewnętrzne:
2022 – POB BioS Dofinansowanie do realizacji prac magisterskich (magistrant: Maciej Garczyk, promotor: Paweł Ferdek)
2022/2023 – POB BioS Research Support Module: Rola fragmentacji mitochondrialnej komórek stelarnych w progresji i oporności na chemoterapię gruczolakoraka przewodowego trzustki (doktorant: Agnieszka Kusiak, opiekun: Paweł Ferdek)
Studentów zainteresowanych dołączeniem do Zespołu i wykonaniem badań w ramach swoich prac licencjackich lub magisterskich prosimy o kontakt na adres mailowy: pawel.ferdek@uj.edu.pl
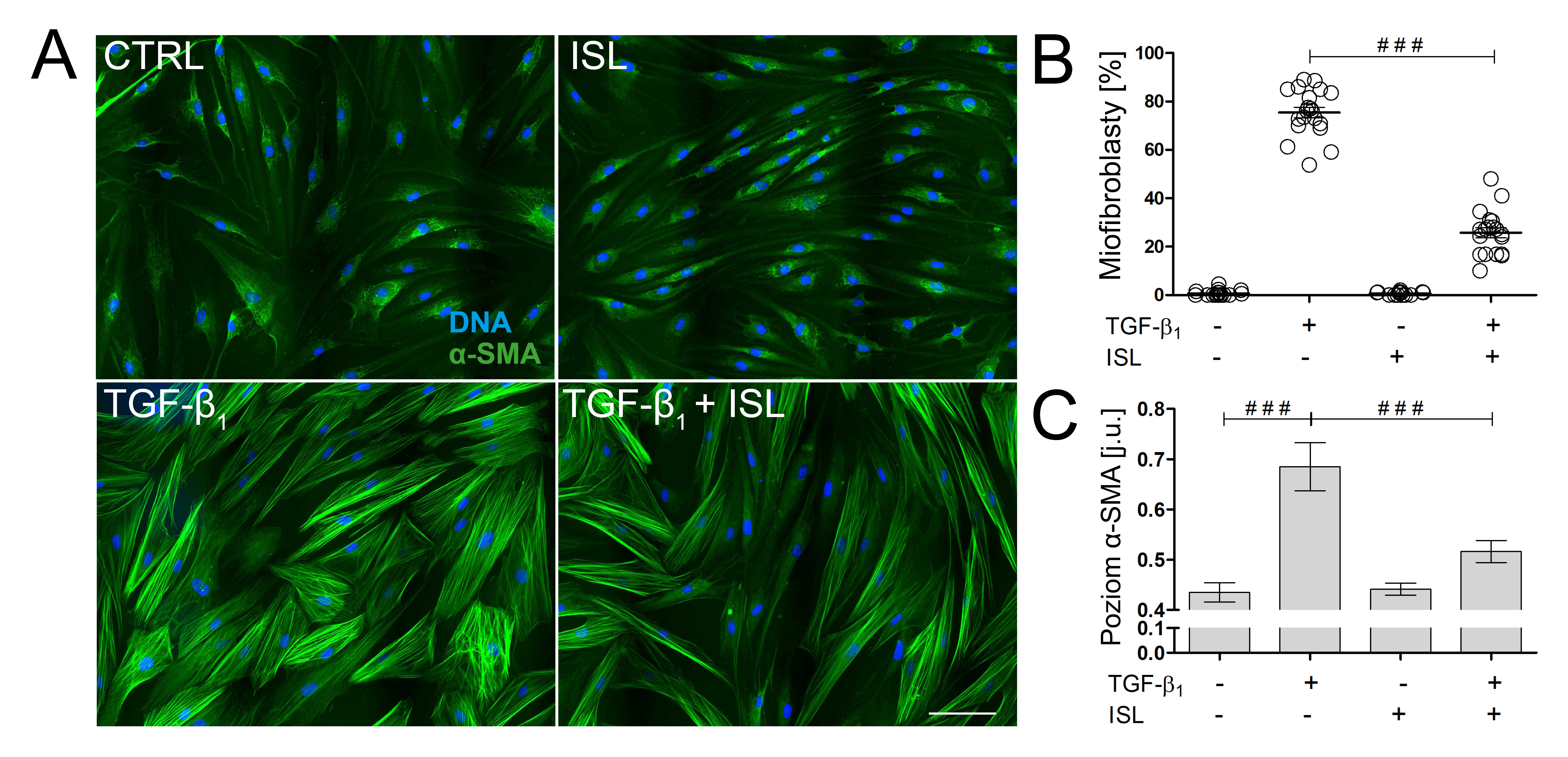
Chalkony oraz ich pochodne wykazują różnorodną aktywność farmakologiczną. Opisano ich właściwości przeciwnowotworowe, antyagregacyjne, przeciwwrzodowe oraz przeciwzapalne. Działają one także bardzo skutecznie na wiele wirusów, bakterii, grzybów i pierwotniaków chorobotwórczych. Ich dobroczynny wpływ przeciwzwłóknieniowy opisano w chorobach zwłóknienia naczyń krwionośnych oraz w zwłóknieniu wątroby.
Badania prowadzone w Zakładzie Biologii Komórki mają na celu identyfikację mechanizmów leżących u podstaw procesów hamowania zmian zwłóknieniowych przez chalkony (izolikwirytygeninę, flawokawainę A, buteinę, likochalkon A), m.in.:
- mechanizmów hamowania indukowanych przez TGF-β1 fenotypowych przejść fibroblastów w miofibroblasty przez wybrane chalkony
- mechanizmów wpływu chalkonów na ekspresję i syntezę składników macierzy zewnątrzkomórkowej wydzielanych przez fibroblasty i miofibroblasty, a także enzymów i inhibitorów tych enzymów mających wpływ na utrzymanie równowagi fizjologicznej składu i architektury macierzy zewnątrzkomórkowej
Kierownik tematu: dr Dawid Wnuk
Osoby zaangażowane w realizację tematyki w ZBK: dr hab. Marta Michalik, prof. UJ, dr Milena Paw
Studentów zainteresowanych dołączeniem do Zespołu i wykonaniem badań w ramach swoich prac licencjackich lub magisterskich prosimy o kontakt na adres mailowy: dawid.wnuk@uj.edu.pl
Indukowane pluripotencjalne komórki macierzyste (ang. induced pluripotent stem cells; iPSCs), stanowią szczególny rodzaj komórek macierzystych, gdyż charakteryzują się nieograniczoną zdolnością do samoodnowy i dużym potencjałem różnicowania we wszystkie linie komórkowe budujące dorosły organizm. Zatem stanowią one doskonałe narzędzie zarówno w badaniach podstawowych, jak i w medycynie regeneracyjnej.
iPSCs powstają w wyniku reprogramowania komórek somatycznych, poprzez wprowadzenie czynników transkrypcyjnych warunkujących pluripotencję (najczęściej są to czynniki: OCT4, SOX2, KLF4, c-MYC). Proces ten prowadzi do uzyskania przez komórki cech typowych dla embrionalnych komórek macierzystych (ang. Embryonic Stem Cells; ESCs). Jednak w przeciwieństwie do ESCs, wykorzystanie komórek iPSCs w badaniach biomedycznych nie wzbudza kontrowersji etycznych.
iPSC uzyskano po raz pierwszy ponad dekadę temu, co otworzyło nową erę w medycynie spersonalizowanej. Komórki te łatwo poddają się modyfikacjom genetycznym, dzięki czemu można je wykorzystać do modelowania różnych chorób. Ponadto, ze względu na szeroką dostępność protokołów do różnicowania komórek iPSCs w różne linie komórkowe (np. kardiomiocyty, neurony, itp.), są one użyteczne jako platformy do testowania nowych leków i analiz toksyczności. Potencjalnie, stanowią one również znakomite źródło komórek do przeszczepów w terapiach komórkowych i genowych. Jednak na szerokie możliwości wykorzystania iPSC w nauce i medycynie ogromny wpływ wywierają warunki środowiskowe. Spośród różnych czynników środowiskowych, tlen odgrywa istotną rolę w regulacji stanu pluripotencji, stabilności genomu, profilu metabolicznego i potencjału różnicowania iPSC.
W naszych badaniach skupiamy się szczególnie na poznaniu wpływu stężenia tlenu, a także temperatury, na stabilność genetyczną i właściwości biologiczne komórek iPSCs oraz wydzielanych przez nie pęcherzyków zewnątrzkomórkowych. Wykorzystujemy plazmidy reporterowe oparte o fluorescencję, system CRISPR/Cas9 oraz analizy wysokoprzepustowe transkryptomu, proteomu i mikro RNA, w celu określenia molekularnego podłoża warunkującego zachowanie i właściwości komórek iPSCs w różnych warunkach tlenowych. Uzyskane wyniki testujemy w modelach chorób in vitro oraz in vivo, celem opracowania nowych terapii chorób monogenowych (np. mukowiscydoza) i łagodzenia skutków zwłóknienia tkanek, które dotyka miliony ludzi na całym świecie.
Realizowane Projekty (patrz zakładka: BADANIA -> PROJEKTY NAUKOWE):
- Sonata 12: UMO-2016/23/D/NZ3/01310 - Impact of hypoxia on molecular characteristic and biological properties, including heart regenerative capacity of extracellular vesicles released by human induced pluripotent stem cells; National Science Centre.
- Tango 4: TANGO-IV-A/0035/2019-00 - Innovative medicine for treatment of organ fibrosis; National Centre for Research and Development.
Kierownik tematu: dr Sylwia Bobis-Wozowicz
Osoby zaangażowane w realizację tematyki w ZBK: dr Milena Paw, dr Paweł Ferdek, dr Dawid Wnuk, mgr Kinga Nit
Lipofekcja (dostarczanie DNA/RNA za pomocą lipidów kationowych) jest szeroko stosowaną techniką, a także jedną z najbardziej obiecujących strategii dla niewirusowej terapii genowej i dostarczania szczepionek DNA. Jednakże, jej główną wadą jest brak skutecznych i bezpiecznych preparatów do lipofekcji. W Zakładzie Biologii Komorki opracowaliśmy innowacyjny system lipofekcji wykorzystujący kationowe pochodne poliprenylu - jodki trimetylopoliprenyloamoniowe (PTAIs). Ponieważ niektóre podstawowe mechanizmy leżące u podstaw wydajnej lipofekcji pozostają nieznane, w trakcie badań są również mechanizmy wychwytu komórkowego nośników opartych na poliprenylu. Nasze badania prowadzimy we współpracy z Instytutem Biochemii i Biofizyki w Warszawie oraz Instytutem Chemii Organicznej Polskiej Akademii Nauk w Warszawie. WIęcej o naszych badaniach można przeczytać w:
- Rak Monika, Góra-Sochacka Anna, Madeja Zbigniew. Lipofection-Based Delivery of DNA Vaccines. Methods Mol Biol. 2021;2183:391-404 (14 stron). PMID: 32959255. W książce: Blaine A. Pfeifer and Andrew Hill (eds.), Vaccine Delivery Technology: Methods and Protocols, Methods in Molecular Biology, vol. 2183, © Springer Science+Business Media, LLC, part of Springer Nature 2021; https://doi.org/10.1007/978-1-0716-0795-4_20
Osoby zaangażowane w realizację tematyki w ZBK: dr Monika Rak, prof. dr hab. Zbigniew Madeja
W ciągu ostatnich kilkunastu lat komórki macierzyste (KM) stały się przedmiotem licznych, prowadzonych na całym świecie badań, dając realne nadzieje na ich zastosowanie w medycynie regeneracyjnej, w tym w kardiologii eksperymentalnej.
Badania prowadzone w Zakładzie Biologii Komórki wpisują się również w tę tematykę i obejmują m.in. optymalizację izolacji oraz hodowli różnych populacji KM i progenitorowych w celu ich zastosowania w regeneracji tkanek uszkodzonych w wyniku niedotlenienia. Komórki wykorzystywane w badaniach pozyskiwane są z kilku ważnych źródeł i obejmują m.in. KM szpiku kostnego, krwi pępowinowej i galarety Whartona oraz inne tkanki, takie jak mięsień sercowy. Z wymienionych źródeł w naszym Zakładzie pozyskujemy m.in. zwierzęce oraz ludzkie komórki macierzyste mezenchymalne (MSCs; ang. Mesenchymal Stem Cells), komórki progenitorowe śródbłonka (EPCs; z ang. Endothelial Progenitor Cells); komórki VSELs (z ang. Very Small Embryonic-Like stem cells) oraz endogenne komórki progenitorowe serca (CSCs; z ang. Cardiac Stem Cells). Niezależnie od KM pozyskiwanych z w/w naturalnych rezerwuarów tkankowych, dzięki zastosowaniu reprogramowania genetycznego udało się również w naszym laboratorium wyprowadzić mysie oraz ludzkie klony pluripotencjalnych komórek iPS (z ang. induced Pluripotent Stem cells).
Z naszych dotychczasowych badań przeprowadzonych we współpracy z ośrodkami w USA (Institute of Molecular Cardiology University of Louisville oraz Cardiovascular Research Institute University of Kansas) wynika, że adherentna subpopulacja komórek MSCs szpiku kostnego o fenotypie niehematopoetycznym (CD45neg) oraz wykazująca ekspresję antygenów komórek prymitywnych oraz mezenchymalnych (m.in. Sca-1, CD90), ale nie wykazująca ekspresji antygenu CD105 (CD105neg) charakteryzuje się zwiększonym potencjałem angiogennym oraz kardiomiogennym w porównaniu z pełną frakcją szpikowych MSCs. Wyniki te stały się m.in. podstawą patentu (US 8,431,162 B2) oraz pozyskania grantu badawczego z NCN.
Podjęte badania mają na celu wyselekcjonowanie wśród heterogennej populacji komórek MSC, frakcji predysponowanej w kierunku różnicowania do komórek śródbłonkowych oraz kardiomiocytów, co potencjalnie zwiększy ich potencjał regeneracyjny po przeszczepie do mięśnia sercowego. Obecnie w naszym Zakładzie prowadzone są badania mające na celu zastosowanie komórek macierzystych pluripotencjalnych pozyskiwanych z tkanek dojrzałych – VSELs oraz indukowanych KM pluripotencjalnych –iPS, dla szeroko pojętych celów kardiologii eksperymentalnej (http://www.stemcells-project.eu/).
Badany jest także potencjalny udział efektów parakrynnych, w tym mikrofragmentów (MVs, z ang. Microvesicles) produkowanych przez KM i progenitorowe w regeneracji tkanek. Badania te prowadzone są w ramach projektu TEAM finansowanego przez FNP.
Kierownik tematu: prof. dr hab.Ewa Zuba-Surma
Osoby zaangażowane w realizację tematyki w ZBK: dr Elżbieta Karnas, dr Anna Łabędź-Masłowska
Optymalizacja metod identyfikacji oraz izolacji różnych populacji komórek macierzystych oraz progenitorowych stanowi ważny aspekt przygotowania tych komórek dla dalszych celów badawczych oraz potencjalnych zastosowań przedklinicznych i klinicznych dla celów medycyny regeneracyjnej.
Z tego względu badania mające na celu identyfikację subpopulacji KM o różnych właściwościach na podstawie ich charakterystycznego profilu antygenowego, prowadzone są w Zakładzie Biologii Komórki nie tylko z zastosowaniem metod cytometrii przepływowej klasycznej oraz cytometrii obrazowej (ImageStream), ale także analiz na poziomie genomu i proteomu komórki (mRNA, miRNA, białka). Do izolacji KM i progenitorowych wykorzystywane są zarówno techniki sortowania immunomagnetycznego (MACS, z ang. Magnetic-Activated Cell Sorting) oraz wieloparametrowego sortowania opartego o fluorescencję (FACS; z ang. Fluorescence-Activated Cell Sorting).
Obecnie w Zakładzie prowadzone są badania mające na celu opracowanie optymalnych metod pozyskiwania oraz namnażania m.in. komórek ze szpiku kostnego i krwi pępowinowej (MSCs, VSELs), subpopulacji tkankowo-specyficznych komórek progenitorowych (EPCs, CSCs) oraz komórek iPS.
Dzięki współpracy z ośrodkami naukowymi w USA – Stem Cell Institute University of Louisville, KY oraz Cardiovascular Research Institute University of Kansas – z zastosowaniem nowoczesnych technik wielokolorowej cytometrii przepływowej oraz obrazowej (ImageStream), udało się opracować unikatowe procedury izolacji komórek VSELs oraz MSCs (US PA No: 20100267107 oraz 20090155225; link: http://www.faqs.org/patents/app/20100267107; http://www.faqs.org/patents/app/20090155225.
W Zakładzie prowadzone są także rutynowo eksperymenty obejmujące namnażanie wektorów wirusowych (służących m.in. do reprogramowania KM) oraz pozyskiwanie ludzkich oraz mysich komórek pluripotencjalnych iPS. Hodowle i ekspansje tych komórek prowadzone są w wystandaryzowanych warunkach: „feeder-layer free" oraz „serum free", co pozwala na uzyskanie czystej kultury tych komórek dla celów transplantacyjnych.
W celu badań nad efektami parakrynnymi użytecznymi w regeneracji tkanek opracowano również metody pozyskiwania oraz zagęszczania frakcji mikrofragmentów (MVs) wydzielanych przez KM. Fenotyp oraz potencjał regeneracyjny pozyskanych MVs po przeszczepieniu do tkanek ischemicznych jest obecnie intensywnie badany w naszym zespole.
Kierownik tematu: prof. dr hab.Ewa Zuba-Surma
Osoby zaangażowane w realizację tematyki w ZBK: dr Elżbieta Karnas, dr Anna Łabędź-Masłowska

